一項針對美國 47 家醫療機構的肥胖患者的回顧性觀察性研究發現,10 年來,接受過減肥手術的患者中有 4% 患上了某些癌症,而未接受此類手術的同齡人中這一比例為 8.9%。
大綱
肥胖增加代謝性疾病與癌症風險
過量和異位體脂肪是脂肪細胞因子和炎症介質的重要來源,它們可以改變葡萄糖和脂肪代謝,導致心臟疾病、代謝和癌症風險增加,從而使無病持續時間和預期壽命縮短 6 至 14 年。據估計,所有癌症中有 20% 可歸因於肥胖,與飲食無關。肥胖會增加患以下癌症的風險:CMAJ Aug 2020, 192 (31) E875-E891; DOI: 10.1503/cmaj.191707
- 大腸(男女)
- 腎臟(男女)
- 食道(男女)
- 子宮內膜(女性)
- 停經後乳房(女性)
肥胖是 13 種不同癌症部位(子宮內膜癌、停經後乳腺癌、結直腸癌、食管癌、腎癌、腦膜瘤、胰腺癌、賁門癌、肝癌、多發性骨髓瘤、卵巢癌、膽囊癌和甲狀腺癌)的確定危險因素。Mol Oncol. 2021 Mar;15(3):790-800.
肥胖增加癌症風險機轉
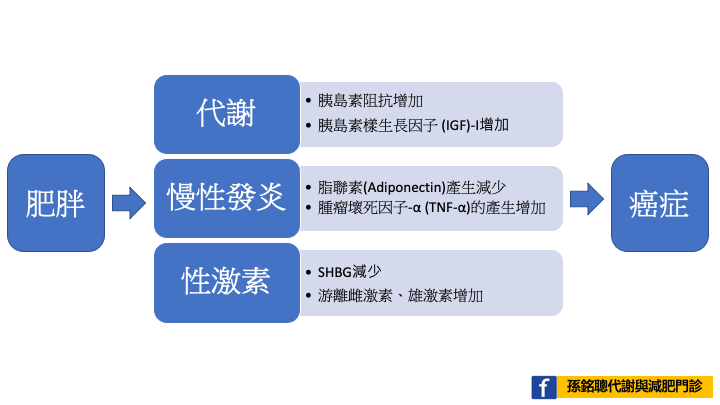
肥胖透過以下三大類機轉影響癌症形成
- 代謝功能和胰島素敏感性
- 慢性低度炎症
- 性激素
代謝功能和胰島素敏感性
肥胖影響胰島素敏感性,讓胰島素阻抗增加,進而增加許多合成性因子,其中游離 IGF-I 水平升高,這可能會促進腫瘤發生。
慢性低度炎症
脂肪組織是一種代謝器官,主要由脂肪細胞組成,脂肪細胞分泌一系列生物活性信號分子,包括促炎性脂肪因子和可能刺激癌症發展的細胞因子。肥胖個體的脂聯素產生減少,導致“低脂聯素血症”狀態和腫瘤發生增加。脂肪細胞釋放的促炎細胞因子本身,包括白細胞介素 6 (IL-6)、IL-1β 和 TNF-α,會增加 C 反應蛋白 (CRP) 和血清澱粉樣蛋白 A (SAA) 的產生,並可能有助於腫瘤發生。
性激素
SHBG 調節游離雌激素的生物利用度,如果游離雌激素未結合,則被認為是高度活躍的,並且與某些激素敏感癌症(尤其是乳腺癌)的風險增加有關。在男性前列腺中,雄激素和雄激素受體調節細胞生長和死亡的速度,並與前列腺癌的發展密切相關。
新出現的假說
身體活動—身體不活動影響活性氧 (ROS) 和抗氧化防御之間的平衡。ROS 可能導致染色體異常、DNA 損傷和腫瘤抑制基因突變。
身體活動影響免疫功能,持續時間較短的有氧運動會刺激免疫球蛋白、嗜中性粒細胞、自然殺傷細胞、細胞毒性 T 細胞和未成熟 B 細胞的短期增加細胞,增強免疫力,進而減少癌症形成。
身體活動可能通過染色體的表觀遺傳改變、DNA 甲基化、microRNA 的表達和染色質結構影響癌症的發展。
腸道微生物群的改變可能解釋了肥胖與癌症之間的某些關聯,因為微生物群可能會產生促癌代謝物,或促進炎症和胰島素抵抗。肥胖和高脂肪飲食而產生的有毒代謝物似乎會通過 ROS 的形成引起 DNA 損傷。並且微生物失調(或“失衡”)與結直腸癌有關。
減肥減少全因死亡率,影響心血管死亡率與癌症死亡率

在2017 年英國醫學雜誌(BMJ)有做過系統評估和薈萃分析(meta-analysis),去看肥胖成人的減肥干預對死亡率、心血管疾病和癌症的影響,在分析 54 項隨機對照試驗,共有 30 206 名參與者,減肥干預可降低全因死亡率( 風險比 0.82,95% 信賴區間 0.71 至 0.95),每 1000 名參與者死亡人數減少 6 人(95% 信賴區間 2至 10)。不過對心血管死亡率雖有影響( 風險比 0.93,95% 置信區間為 0.67 至 1.31),極低質量的證據表明對癌症死亡率有影響( 風險比 0.58,95% 置信區間 0.30 至 1.11)但是未達統計意義。BMJ 2017; 359 doi: https://doi.org/10.1136/bmj.j4849 (Published 14 November 2017)
減肥手術將肥胖相關癌症的風險減半研究
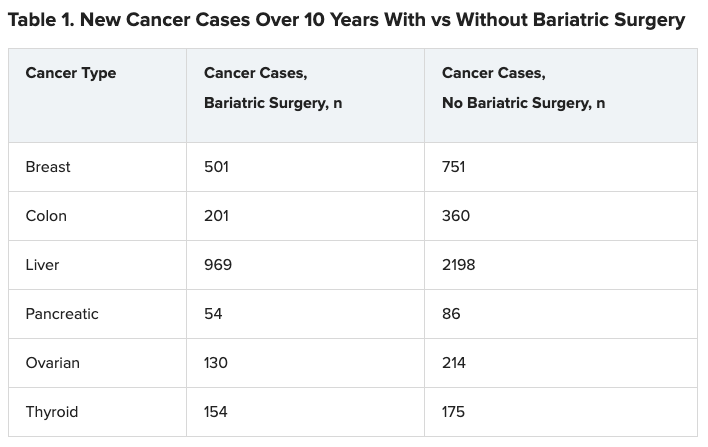
在2023年最新報告中,一項針對美國 47 家醫療機構的肥胖患者的回顧性觀察性研究發現,10 年來,接受過減肥手術的患者中有 4% 患上了某些癌症,而未接受此類手術的同齡人中這一比例為 8.9%。 在 10 年持續追蹤中,2206 名接受減肥手術的患者患上了肥胖相關癌症,而未接受減肥手術的患者為 4960 名。減肥手術組六種癌症的新病例數較少,包括乳癌、大腸癌、肝癌、胰臟癌、卵巢癌、甲狀腺癌,其中乳癌 ( P = .001)、大腸癌 ( P < .01)、肝癌 ( P < .01) 和卵巢癌 ( P = .002)達顯著統計意義。


